CDH17 ADC
CDH17是鈣粘蛋白超家族的成員,鈣粘蛋白超家族是一組鈣依賴性細胞粘附分子,對器官發育、組織完整性和癌症進展至關重要。
鈣粘蛋白包含細胞外結構域、跨膜結構域和細胞內結構域,CDH17結構不同於經典鈣粘蛋白,包括EC1到EC7七個cadherin重複序列和18-20個氨基酸的胞內結構域(圖1)[1]。
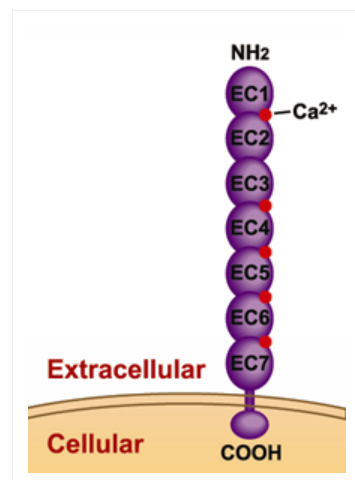
圖1. CDH17結構
在正常組織中,CDH17高度侷限於側膜,隱藏在無法接近的腸道緊密連接處。相比之下,它在50%至90%的胃腸道癌症中過表達和重新分佈,導致其暴露於癌細胞表面,因此變得更容易獲得。這一獨特功能使 CDH17 成爲基於抗體的治療的有前途的靶點。
今年AACR會議上,多家公司報道了其CDH17藥物研發進展,包括維立志博的LBL-054、華東醫藥的HDM2017、Tavotek Biotherapeutics的TAVO307、宜聯生物的YL127、SOTIO Biotech的SOT109、博奧信生物的BSI-721、橙帆醫藥的VBC108、禮新醫藥的LM-350、先聲藥業的SCR-A008等。
1.1 LBL-054
LBL-054是由南京維立志博生物開發的靶向CDH17 ADC藥物,由人源化CDH17 IgG1 單克隆抗體與他們專有的接頭-有效載荷平臺偶聯而成。
今年AACR會議上,維立志博報道了LBL-054在臨牀前異種移植模型中表現出抗腫瘤功效(圖2)[2]。
研究結果顯示:LBL-054表現出適當的親和力和快速的內化。在CDH17陽性癌細胞的殺傷試驗中,LBL-054比LBL-054-Dxd偶聯物更有效,而LBL-054 比LBL-054-Dxd偶聯物更不容易殺死CDH17陰性細胞。而且,LBL-054表現出比LBL-054-Dxd偶聯物更強的旁觀者效應。
LBL-054在血漿穩定性試驗中高度穩定。在異種移植模型中,誘導腫瘤消退的單劑量LBL-054比LBL-054-Dxd偶聯物更有效,並且比LBL-054-Dxd偶聯物的PK更好。
總之,通過與具有可切割/親水接頭的高效/旁觀者/非pgp底物TOP1i有效載荷exatecan偶聯,靶向CDH17的LBL-054在血漿中表現出高穩定性、強大的抗腫瘤活性和良好的異種移植模型中的良好耐受性,支持LBL-054用於CDH17表達腫瘤患者的臨牀開發。

圖2. LBL-054的AACR信息
1.2 HDM2017
HDM2017是由華東醫藥自主研發的靶向CDH17的ADC,由靶向CDH17人單克隆抗體與CPT衍生物有效載荷化學偶聯而得,正在進行IND支持研究。
今年AACR會議上,華東醫藥公佈了HDM2017的體外和體內臨牀前研究結果:HDM2017與CRC和GC細胞表現出優異的細胞結合活性,EC50範圍爲0.1-1.0 nM(圖3)[3]。
此外,HDM2017表現出強大的靶標介導的內化活性,實現了43-75%的內化效率。HDM2017在一系列表達CDH17的腫瘤細胞系中顯示出有效的體外抗腫瘤活性。HDM2017處理導致CDH17人CRC(71~97% TGI)和GC(71~90% TGI)異種移植模型中的腫瘤生長顯着抑制,表明HDM2017有可能爲胃腸道癌症患者提供臨牀益處。

圖3. HDM2017的AACR信息
02MSLN ADC
MSLN(Mesothelin,間皮素)是一種細胞表面分子,以成熟形式表達爲通過糖基磷脂酰肌醇鍵固定在細胞膜上的40 kDa蛋白。
MSLN結構主要由細胞外結構域,包含一個信號肽、一個成熟肽和一個跨膜錨定區以及跨膜錨定區組成(圖4)[4]。
其中成熟肽部分在細胞表面表達,是抗體藥物和免疫療法的主要靶點,MSLN通過跨膜錨定區固定在細胞膜上,使其能夠穩定地表達在細胞表面。
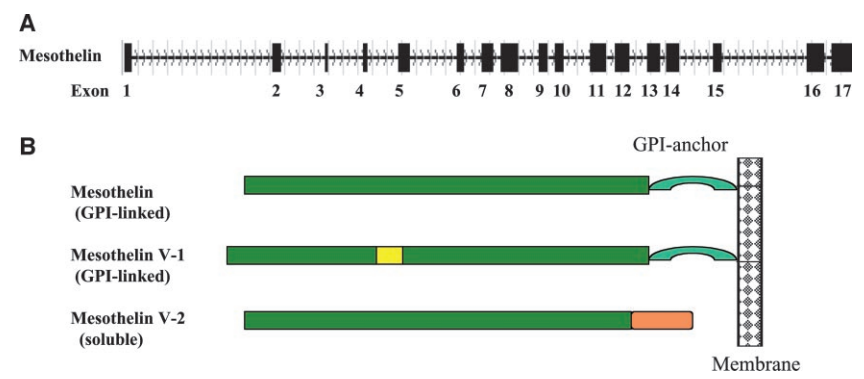
圖4. 間皮素基因及其編碼的蛋白質的示意圖
MSLN在體內與很多信號通路相關,如通過與可溶性或細胞表面MSLN相互作用,MSLN可以觸發 Akt、ERK1/2 和 JNK 信號通路。
Akt和ERK1/2信號轉導的下游作用包括抑制Bim、Bad和Bax,然後抑制細胞凋亡和/或刺激 Bcl-xl/Bcl-2導致細胞存活。Akt、ERK1/2和JNK通路顯示會增加基質金屬蛋白酶7(MMP-7)的表達,從而導致細胞遷移和侵襲速率。MMP-7 通路也可以通過SGK3/FOXO3和p38通路。SGK3/FOXO3 信號轉導也被證明會導致DKK1的下調和表達,從而增加細胞遷移(圖5)[5]。
MSLN的異常與很多疾病相關,在許多實體瘤中過表達,包括卵巢癌、胰腺癌、子宮內膜癌、肺癌和結直腸癌等。
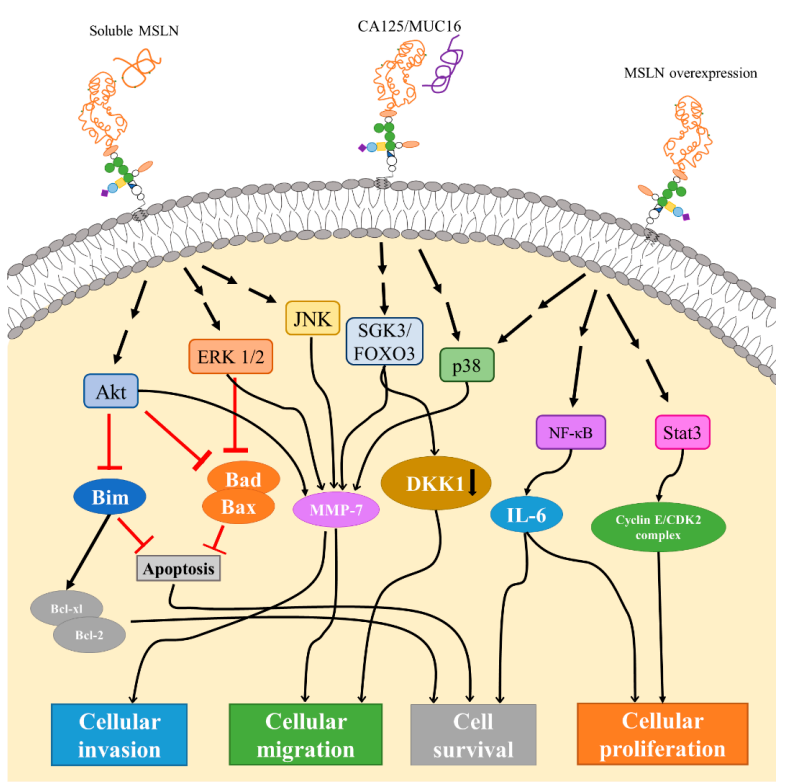
圖5. MSLN介導的相關信號通路
自發現以來,MSLN一直是各種方式的抗腫瘤療法開發的目標,有很多不同在研藥物類型,包括抗體、CAR-T 和多種ADC藥物等。
2.1 PF-08052666
PF-08052666是由輝瑞與和鉑醫藥合作開發的一種靶向MSLN的ADC,通過可裂解的甲磺酰基嘧啶三肽連接子將抗MSLN單克隆抗體與新型拓撲異構酶1抑制劑SGD-12280連接而得。
PF-08052666 旨在通過新型抗體、差異化有效載荷和更高的藥物抗體比 (DAR)來克服上一代抗MSLN ADC的缺點(圖6)[6]。
在體外,PF-08052666通過向MSLN陽性細胞遞送有效載荷來驅動直接細胞毒性,旁觀者對共培養的MSLN陰性細胞進行旁觀者殺傷活性,並在生理相關濃度的可溶性MSLN存在下保持細胞毒性。
在體內,PF-08052666 在各種腫瘤類型(包括卵巢癌、肺癌和結直腸癌)的細胞系和患者來源的異種移植模型中優於基於DM4的抗MSLN基準ADC。這些數據支持PF-08052666正在進行的晚期實體瘤患者1期臨牀試驗,該試驗目前正在招募(NCT06466187)。
圖6. PF-08052666的AACR信息
2.2 RC88
RC88是由榮昌生物自主研發的新型靶向MSLN的 ADC藥物,具有first-in-class潛力,榮昌生物採用自主研發的創新橋接技術,將MSLN靶向抗體、可裂解連接子以及小分子細胞毒素(MMAE)連接而得,通過靶向結合MSLN陽性的腫瘤細胞,RC88能夠介導抗體的內吞,將細胞毒素定向傳遞給癌細胞,實現較好的腫瘤殺滅效果。
榮昌生物的ADC平臺具有下述主要功能:ADC連接子及載荷優化的篩選平臺;專有橋接(Thiel-bridge)偶聯技術;連接子、載荷及偶聯工藝開發; 連接子、載荷及連接載荷的GMP合成;ADC的DS和DP的GMP生產。
RC88已獲得美國FDA授予的快速通道資格,用於治療鉑耐藥複發性上皮性卵巢癌、輸卵管癌和原發性腹膜癌,目前正處於晚期實體瘤的I/II期試驗中,無論是單藥治療(NCT04175847、NCT06173037)還是聯合治療(NCT05804526)。
今年的AACR會議,榮昌生物揭示了RC88的獨特特性,RC88 對不同的 MSLN區域具有獨特的結合動力學,通過嚴格的方法具有占主導地位的N端結合位點(圖7)[7]。
RC88與其他抗MSLN抗體相比,對MSLN陽性癌細胞的結合效果更好,並且在sMSLN干擾下仍保持有效性。與其他抗體相比,它與C端MSLN片段的結合更強,進一步強調了其在腫瘤細胞中的靶向潛力。
鑑於其獨特的結合特性,RC88可能爲治療MSLN陽性癌症帶來增強的臨牀益處,即使腫瘤細胞中存在sMSLN和各種截短形式的MSLN。因此,RC88在臨牀研究中可能比其他MSLN ADC具有更大的臨牀益處。

圖7. RC88的AACR信息
03PSMA ADC
PSMA(前列腺特異性膜抗原)是一種II型跨膜糖蛋白,包含跨膜結構域、細胞外結構域以及酶活性區域,PSMA具有N-乙酰基-α-氨基己糖苷酶(GluN)的酶活性,能夠水解N-乙酰氨基己糖苷,這種酶活性在某些生理和病理過程中發揮作用(圖8)。
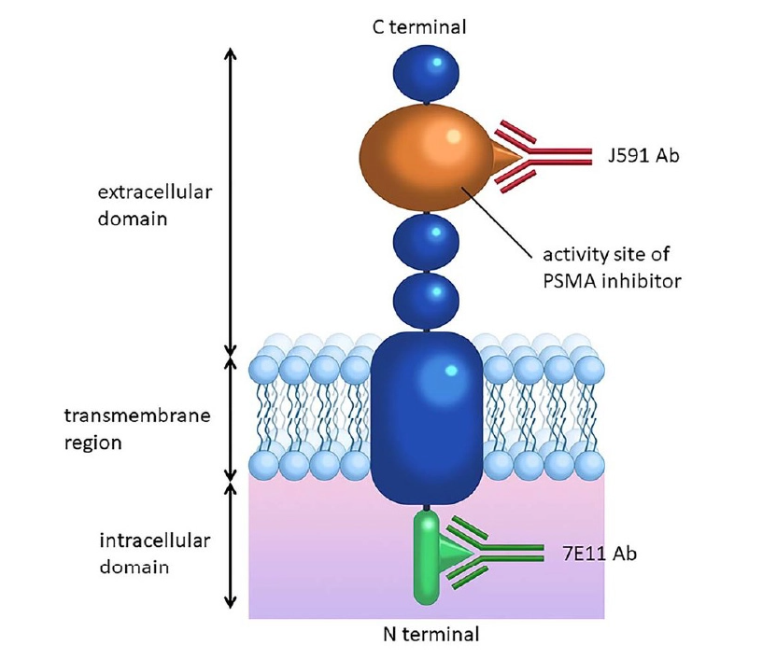
PSMA在絕大多數前列腺癌(PCa)細胞中高表達(正常值的100-1000倍),包括晚期疾病患者、去勢抵抗性疾病患者和低分化疾病患者。此外,PSMA對前列腺癌細胞的內化率很高。
由於其在前列腺癌中的普遍存在以及上述特徵,PSMA已成爲前列腺癌患者影像學模式和治療方法研究的有吸引力的目標,是一個成熟的靶向前列腺癌的診斷和治療領域,目前開發的靶向PSMA的治療方法有放射性配體治療、ADC藥物和CAR-T細胞療法等。
3.1 GenSci143
B7-H3和PSMA都是在PCa中表現出高水平表達的腫瘤相關抗原,用單一藥物雙重靶向它們代表了治療轉移性去勢抵抗性前列腺癌(mCRPC)的一種有前途的治療方法。
GenSci143是由金賽藥業開發的一種高度差異化的B7-H3 x PSMA雙抗ADC,由針對B7-H3和PSMA的雙特異性抗體、高度穩定但可切割的連接子和有效的拓撲異構酶1抑制劑有效載荷組成。GenSci143作爲新型靶向癌症療法的潛力目前正在臨牀前研究中進行評估。
今年AACR會議上,金賽藥業帶來了GenSci143最新進展:GenSci143在表達B7-H3或PSMA或兩者TAA的腫瘤細胞中顯示出很強的體外結合、內化和細胞毒性(圖9)[8]。
在體內,GenSci143在不同B7-H3和PSMA表達水平上有效誘導腫瘤消退,並顯示出優於DS-7300和ARX517類似物的抗腫瘤功效。
此外,GenSci143的體外血漿穩定性比DS-7300好得多。食蟹猴以10 mg/kg 靜脈注射後,GenSci143表現出良好的藥代動力學特徵,在任何時間檢查的血清遊離有效載荷濃度均低於1.0 ng/mL。在食蟹猴的非GLP重複劑量毒性試點研究中,GenSci143的耐受性良好,根據 PK-PD 建模和模擬,其治療指數明顯高於 DS-7300。
這些結果表明,GenSci143有可能成爲mCRPC患者的有效治療選擇,並支持其在IND支持研究中進一步評估。

圖9. GenSci143的AACR信息
3.2 SDV2102
SDV2102是由Syndivia開發的一種靶向PSMA的ADC藥物,採用GeminiMab™技術將新型抗PSMA抗體D1與微管蛋白抑制劑MMAE偶聯而得,主要用於治療轉移性去勢抵抗性前列腺癌(mCRPC)
值得注意的是,SDV2102 的藥物抗體比(DAR)爲 1,允許更高的劑量和更高的療效,而不會成比例地增加全身毒性,從而提高治療指數。
今年AACR會議,Syndivia帶來了SDV2102 的臨牀前評價結果:在C4-2 細胞來源的異種移植物(CDX)模型中,當以等劑量的 MMAE 給藥時,SDV2102 顯示出比使用通用J591抗體或D10抗體構建的經典DAR4 ADC具有顯著更高的抗腫瘤功效(圖10)[9]。
此外,SDV2102在具有低至中等PSMA表達水平的患者來源異種移植物 (PDX)模型中顯示出有效的活性。
大鼠藥代動力學研究表明,SDV2102 具有良好的特徵,與未偶聯的 D10 抗體非常相似,表明在循環中保持了抗體樣特徵。C4-2 模型中的劑量反應研究確定了2.5 mg/kg的最小有效劑量。
對非人靈長類動物的毒理學研究表明,在高達24 mg/kg 的劑量下沒有重大毒性,未達到最大耐受劑量(MTD),表明治療窗口很寬。SDV2102 的治療指數爲 38,具有相當大的安全邊際。這些臨牀前結果支持 SDV2102 作爲治療 mCRPC的有前途的治療候選藥物進入臨牀試驗。

圖10. SDV2102的AACR信息
CEACAM5(通常稱爲CEA)是癌胚抗原相關細胞黏附分子(CEACAM)家族的成員之一。CEACAM家族包含12個成員,其中CEACAM5是最早被發現並廣泛研究的成員(圖11)[10]。
CEACAM5通過糖基磷脂酰肌醇(GPI)與細胞膜結合,包含7個免疫球蛋白樣結構域,一個可變(IgV)樣結構域(N結構域),以及三個重複單元,包括六個IgC樣結構域(A1-B3)
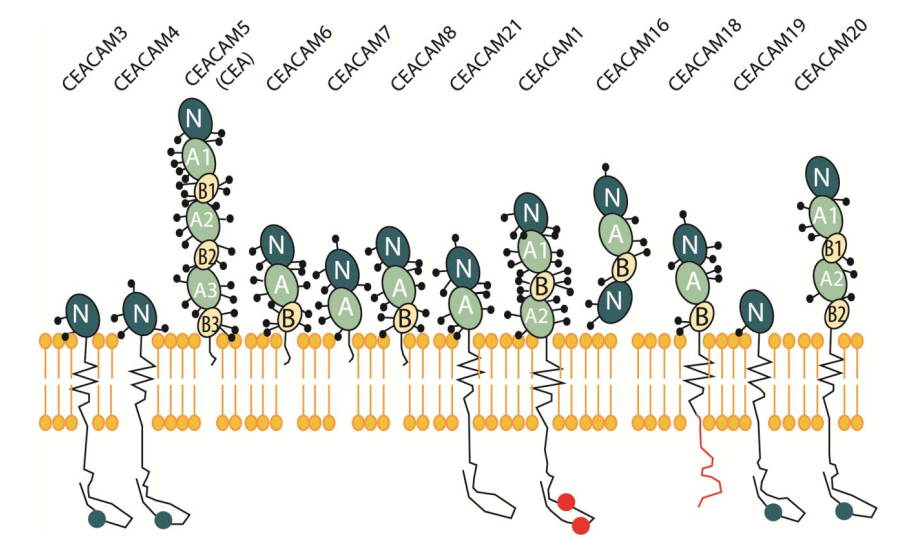
圖11. CEACAM家族成員結構
CEACAM5在多種上皮腫瘤中高表達,包括結腸癌、胃癌、胰腺癌、卵巢癌和肺癌,靶向CEACAM5的治療策略正在不斷開發中,包括ADC藥物、单域抗体藥物偶联物(UdADC)、雙特異性抗體以及CAR-T細胞療法等。
4.1 BG-C47
BG-C477是由百濟神州開發的一款靶向CEACAM5(CEA)的ADC藥物,由CEACAM5特異性抗體通過可切割接頭與Top1i有效載荷偶聯(藥物抗體比 = 8)組成,主要用於治療晚期實體瘤,特別是肺癌和胃腸道腫瘤。
今年AACR會議,百濟報道了BG-C477的研發進展。
與抗CEA DM4 ADC相比,BG-C477與表達CEA的MKN45細胞具有特異性結合和更強的內化活性。BG-C477在不同CEA表達水平的細胞系中表現出穩健且CEA依賴性的細胞毒性。
在與CEA陽性MKN45和陰性HCT116細胞混合的共培養殺傷試驗中觀察到BG-C477的有效旁觀者效應,表明具有治療異質性 CEA 表達的腫瘤的潛力。在動物研究中,BG-C477在多個表達CEA的CDX 和PDX模型中顯示出有效和劑量相關的單藥療效。此外,BG-C477在GC和CRC PDX模型中表現出優異的抗腫瘤功效,而抗CEA DM4 ADC無效。
綜上所述,BG-C477 是一種很有前途的CEA靶向ADC,在多種類型的腫瘤中具有很強的抗腫瘤活性。評估 BG-C477 的安全性、耐受性、藥代動力學、藥效學和初步抗腫瘤活性的人體研究正在進行中(NCT06596473)[11]。
圖12. BG-C477的AACR信息
本文轉發自微信公衆號“新康界”,文章作者爲BiG生物創新社;FOREXBNB編輯:文文。








